3月20日,国际权威学术刊物自然出版集团旗下子刊《Nature Communication》在线发表中国科学技术大学合肥微尺度物质科学国家研究中心蔡刚课题组与加拿大拉瓦尔大学癌症研究中心Jacques Côté教授课题组联合攻关的研究论文。在基金委(31570726 and 31170694)和科技部 (2014CB910700) 基金的资助下,蔡刚课题组解析了来源酿酒酵母的乙酰转移酶NuA4/Tip60复合体的4.7埃分辨率的冷冻电镜结构,清晰描绘了亚基间的相互作用界面,揭示了NuA4/Tip60组装和调控的机制。中国科大和中国科学院分子细胞科学卓越中心蔡刚教授和中国科大王雪娟研究员为共同通讯作者。
NuA4/TIP60复合体是进化中非常保守和必需的多亚基复合体,具有乙酰化组蛋白H4/H2A和激活转录的能力,广泛参与了基因转录激活、DNA损伤修复、细胞周期等重要的细胞生理过程。除组蛋白底物外,NuA4/TIP60能乙酰化包括p53和众多转录因子在内的250多种非组蛋白底物,关键性地调控新陈代谢、自噬和细胞稳态、干细胞的维持和更新。人类催化亚基Tip60与其他几个NuA4/TIP60亚基包括TRRAP的突变,与多种癌症,如结肠癌、乳腺癌和前列腺肿瘤的肿瘤发生密切关联。
NuA4/TIP60复合体包含数十个蛋白质亚基,并与几种染色质重塑复合体(SWR1,INO80和人类SWI/SNF)或组蛋白修饰复合体(SAGA HAT和Rpd3S HDAC)共享六个亚基。受限于NuA4/TIP60复合体高度的组成复杂性和构象多变性,传统的分析手段难以达到足够的精度,迄今为止,我们对NuA4/TIP60复杂装配及其调控机制的理解受到了严重阻碍。
蔡刚教授课题组利用冷冻电镜,解析了4.7埃分辨率的NuA4/TIP60复合体TEEAA亚复合物(包含Tra1,Eaf1,Eaf5,Actin和Arp4亚基)和7.6埃分辨率的的TEEAA-piccolo NuA4亚复合物(包含Tra1,Eaf1,Eaf5,Actin,Arp4,Esa1,Epl1,Yng2和Eaf6亚基)的高分辨率结构,清晰揭示了NuA4/Tip60的组装及其调节界面:表明复合体最大的Tra1/TRRAP亚基(约430kDa)与Eaf1一起用作NuA4装配的支架。其中,Actin/Arp4模块位于外围区域,与Eaf1 HSA结构域相关联。Eaf1 SANT结构域通过离子相互作用紧密结合Tra1/TRRAP的LBE和FATC结构域。Eaf5/7/3(TINTIN)和Piccolo模块主要结合在Tra1的FAT和HEAT重复区域,同时分别与Eaf1 N-末端和HSA区域相互作用。蔡刚课题组与Jacques Côté教授课题组的紧密合作,共同验证了NuA4/Tip60复合体组装和调控界面的结构及相关发现。
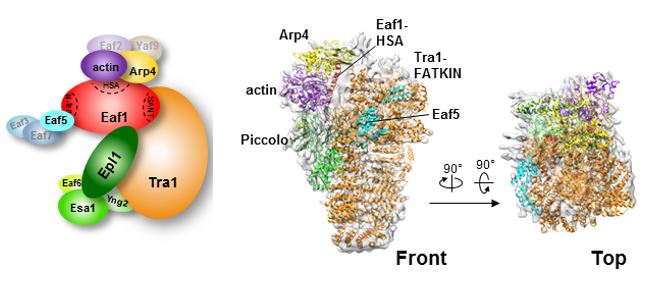
图.NuA4/TIP60复合体的亚基/模块架构及其高分辨率冷冻电镜结构
