肾细胞癌是发生于肾小管上皮的一种恶性肿瘤,其中肾透明细胞癌是最为常见的病理子类型。早期对肾细胞癌发病机制的深入研究发现:肾细胞癌中一些关键的基因,如Hippel-Lindau (VHL)抑癌基因等易发生高频突变,致下游的蛋白与信号通路异常激活,导致新生血管生成,从而促进肾细胞癌的发生、发展与转移。因此,抗血管生成的抑制剂被作为进展性肾细胞癌患者的一线治疗方案,如舒尼替尼、索拉非尼等。然而,这些分子的靶向药物在临床应用的疗效往往不尽如人意,肾细胞癌患者出现不同程度的耐药与疾病进展,不能有效延长患者的生存期。亟需探索肾细胞癌新生血管形成的生物学机制,这对于开发新的临床靶向治疗药物与预测治疗疗效的生物学标志物具有十分重要的意义。
血管内皮细胞生长因子(VEGF)家族目前主要包括VEGFA、VEGFB、VEGFC、VEGFD和胎盘生长因子,其中VEGFA是诱导肿瘤血管形成作用最强的血管生长因子。肿瘤细胞通常高表达VEGFA,它通过结合其主要受体血管内皮生长因子受体VEGFR2,从而促进内皮细胞的分化、增殖、迁移与血管形成。因此,VEGFA/ VEGFR2信号通路在肿瘤的新生血管中起着关键的作用。苏州医工所肿瘤生物标志物实验室在2021年2月发表于国际期刊Cancer Research的研究“DMDRMR-Mediated Regulation of m6A-Modified CDK4 by m6A Reader IGF2BP3 Drives ccRCC Progression”中,新鉴定到的一个全新长链非编码RNA DMDRMR直接结合IGF2BP3蛋白,协助其阅读及调控细胞周期蛋白依赖性激酶4(CDK4)等m6A修饰的靶基因,从而促进肾透明细胞癌细胞的转移与侵袭。此外,研究人员还发现DMDRMR促进VEGFA的表达水平及调控血管生成相关的生物通路,而这些作用不依赖于它的结合蛋白IGF2BP3,基于此,研究人员提出新的科学问题:DMDRMR是否及如何促进肾透明细胞癌的新生血管生成?
为了研究回答这些科学问题,研究人员首先通过体外内皮细胞血管形成与体内基质胶栓血管生成实验,证实DMDRMR显著促进内皮细胞的血管形成能力。随后,为了进一步阐明DMDRMR调控这一功能的信号通路,研究人员通过生物信息学分析及RNA结合蛋白免疫沉淀等实验证实,DMDRMR能竞争性结合抑癌miR-378a-5p,以释放其对靶基因果蝇zeste基因增强子的人类同源2(EZH2)和Smad泛素调节因子1(SMURF1)的表达抑制作用,促进二者对人DOC-2/DAB2相互作用蛋白基因(DAB2IP)的转录与翻译进程的阻滞,进而激活VEGFA/VEGFR2信号通路,导致肾透明细胞癌的血管生成及对抗血管形成药物舒尼替尼的抵抗。
此外,该研究还通过卡方检验、Spearman相关性与Kaplan-Meier生存分析等统计方法对多个不同来源的临床队列分析发现,肾透明细胞癌患者中,miR-378a-5p与DAB2IP的表达水平呈显著下调及正相关,而DMDRMR与二者呈负相关,DMDRMR高表达且DAB2IP低表达的患者具有较差的生存预后,表明了DMDRMR/ miR-378a-5p/DAB2IP轴对肾透明细胞癌抗血管生成的靶向治疗与疗效预测具有潜在的指导作用。
综上所述,本研究新鉴定了一个全新的肾透明细胞癌新生血管形成及抵抗抗血管药物的调控机理,为该肿瘤的治疗提供了可观的指导策略。研究成果于近日在Cell Death and Diseases期刊在线发表,朱雨朦与刘小君硕士研究生为本论文的第一作者,高山研究员与顾殷敏研究助理为共同通讯作者。该工作得到了基金委、中科院战略先导等项目的支持。
据悉,苏州医工所肿瘤生物标志物实验室围绕肿瘤生物标志物鉴定取得一系列成果,在国际权威期刊上发表多项研究成果,其中包括PNAS(2篇),Science Advances,Cancer Research(2篇)等。
论文链接:https://doi.org/10.1038/s41419-022-04898-3.
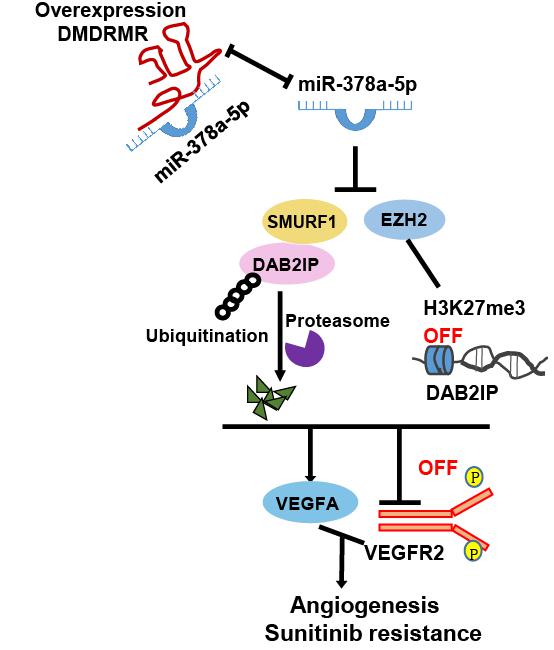
图1 DMDRMR/ miR-378a-5p/DAB2IP调控模式图
