中国科学技术大学合肥微尺度物质科学国家研究中心罗毅教授团队叶树集研究员小组在生物膜界面蛋白质错误折叠及振动能量转移超快动力学研究两方面取得新进展。该小组揭示了与二型糖尿病相关的胰岛淀粉样多肽(hIAPP)在生物膜上错误折叠过程的结构演变机制,以及界面蛋白质与水分子间的共振能量传递捷径,研究成果分别以Misfolding of Human Islet Amyloid Polypeptide at Lipid Membrane Populates through β-Sheet Conformers without Involving α-Helical Intermediates为题发表在《美国化学会志》(J. Am. Chem. Soc.2019,141, 1941-1948),以Ultrafast Energy Relaxation Dynamics of Amide I Vibrations Coupled with Protein-Bound Water Molecules为题发表在《自然•通讯》(Nat. Commun.2019,10, 1010)上。
细胞膜界面蛋白质的错误折叠与二型糖尿病等神经退化型疾病的发生和发展密切相关。错误折叠涉及b-折叠等各种纤维化中间体的生成。目前人们对界面蛋白质错误折叠及其破坏膜结构机理的了解甚少,且存在多种争议,包括b-折叠多聚体是否最后转变成纤维结构、折叠初期构象是a-螺旋还是并排b-发夹结构、b-折叠多聚体是在溶液还是在膜界面上形成等等。研究者根据界面敏感的和频光谱谱学特征,发现界面蛋白质指纹区酰胺II信号可以有效区分界面蛋白质b-发夹样单体与b-折叠多聚体等错误折叠中间体结构。把酰胺 I、酰胺II和酰胺III谱学特征结合起来,揭示了与二型糖尿病相关的胰岛淀粉样多肽(hIAPP)在生物膜上结构演变途径:无规卷曲®b-发夹样单体®b-折叠多聚体®纤维(图1)。研究表明hIAPP纤维化过程中不涉及a-螺旋中间体,以及b-折叠多聚体在膜界面上产生而不是在溶液中形成(J. Am. Chem. Soc.2019,141, 1941)。
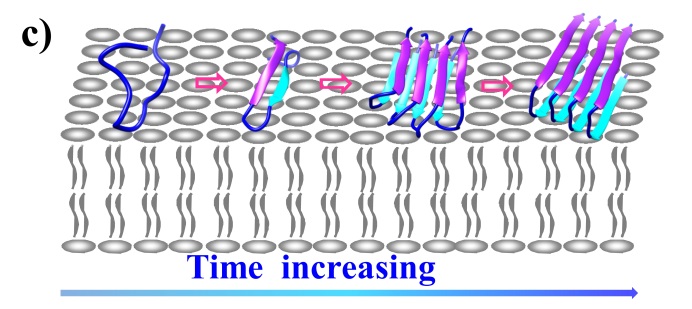
图1、hIAPP在生物膜界面错误折叠过程结构演变机制
此外,理解生物膜上蛋白质的能量转移过程对揭示界面蛋白质分子间相互作用以及蛋白质工作机制非常关键。研究者利用振动态选择激发和频光谱探测的飞秒时间分辨测量系统,通过选择激发酰胺键C=O基团,然后探测其瞬态结构变化,成功测出水环境下蛋白质酰胺键C=O振动驰豫时间。研究发现,暴露于水环境的蛋白质残基数量越多,C=O振动驰豫时间越快(图2a)。该工作揭示了界面蛋白质与水分子弯曲振动在能量上的耦合作用(图2b),水分子不仅作为“热库”加快分子内振动弛豫,而且通过直接的振动共振能量转移通道为蛋白质与溶剂间的能量转移提供“捷径”(2c) (Nat. Commun.2019,10, 1010)。以上工作得到国家重点研发计划、自然科学基金重点和面上项目、中央高校重要方向项目培育基金、中科院等的资助。

图2、水环境下蛋白质酰胺键C=O振动驰豫时间(a),酰胺键与水分子耦合作用(b),酰胺键C=O振动驰豫途径示意图(c)。
论文信息:Junjun Tan,Jiahui Zhang, Yi Luo, Shuji Ye*, Misfolding of Human Islet Amyloid Polypeptide at Lipid Membrane Populates throughb-Sheet Conformers without Involvinga-Helical Intermediates.J. Am. Chem. Soc.2019,141, 1941-1948.
https://pubs.acs.org.ccindex.cn/doi/abs/10.1021/jacs.8b08537
Junjun Tan,Jiahui Zhang,Chuanzhao Li, Yi Luo*, Shuji Ye*, Ultrafast Energy Relaxation Dynamics of Amide I Vibrations Coupled with Protein-Bound Water Molecules.Nat.Commun.2019,10,1010.https://www.nature.com/articles/s41467-019-08899-3
(合肥微尺度物质科学国家研究中心、科研部)
